科学研究
新品上市|小鼠发情周期快速鉴定试剂盒发布,生殖学研究效率新升级

近日,南京爱贝生物科技有限公司自主研发的小鼠发情周期快速鉴定试剂盒正式上市。该产品实现小鼠发情周期鉴定的标准化,可提高科研人员获取高品质卵母细胞的效率。
在生殖学研究中,小鼠发情周期的准确判断直接影响着卵母细胞获取数量、质量及后续胚胎发育效果,为优化配种策略、制定科学超排方案提供可靠依据。若促排实验前未进行发情周期鉴定,易导致促排效果不稳定、实验数据重复性差等问题。依托多年在胚胎培养领域的技术积淀,我司针对性研发的这款产品,凭借两大核心优势破解行业痛点。
提升小鼠获卵个数与质量
基于PMSG/HCG经典促排方案验证数据,采用本试剂盒准确鉴定ICR小鼠发情前期并进行促排卵实验,单只小鼠平均获卵数从间情期的30枚提升至50枚。同时,发情前期获取的卵母细胞质量优于间情期,其受精率及囊胚形成率较其他周期阶段显著提升。
操作省时省力,减少小鼠用量
试剂盒采用即用型设计,提供实验所需全部试剂与耗材。整个染色鉴定流程仅需30分钟,借助该试剂盒可准确鉴定小鼠发情前期、发情期、发情后期及间情期,避免因小鼠在不同发情阶段导致的促排效果不稳定、实验数据重复性差等问题。在小鼠发情前期进行促排,可大大减少实验用鼠数量,降低小鼠饲养成本与伦理压力,更契合动物实验3Rs原则(替代、减少、优化),兼顾科研效率与伦理合规。
作为一款聚焦科研痛点的创新产品,小鼠发情周期快速鉴定试剂盒可广泛应用于生殖生物学、基因编辑、胚胎工程等领域,为高校实验室、科研院所、生物制药企业等机构提供可靠的实验工具。
如需进一步了解产品使用信息或申请试用,可拨打销售热线025-66068668咨询,南京爱贝生物将为您提供专业的技术支持与服务。
HTF培养液高钙配方的科学解读

HTF(Human Tubal Fluid,人输卵管液)的核心设计理念是模拟人类输卵管内的生理环境,而钙离子(Ca²⁺)作为受精全过程的关键调控因子,发挥着不可替代的作用,这也是HTF采用高钙配方的核心逻辑基础。
Ca²⁺是保障精卵结合及胚胎启动的关键信号分子,具体作用体现在三方面:
• 精子获能与顶体反应:Ca²⁺是启动精子获能的核心信号分子,同时可触发精子顶体反应(AR),使精子获得穿透卵子透明带的能力;
• 卵母细胞激活:受精瞬间,精子带入卵母细胞的PLCζ酶需依赖Ca²⁺才能诱发卵内钙振荡,进而启动胚胎发育的一系列关键程序;
•精子-卵膜融合:Ca²⁺依赖性蛋白(如IZUMO1-JUNO蛋白复合体)是介导精卵细胞膜特异性结合的核心物质。
基于Ca²⁺的关键作用,HTF培养液的钙浓度显著高于KSOM等普通胚胎培养液,核心目标是通过精准调控Ca²⁺水平保障受精效率,具体表现为:
快速诱导精子超活化(Hyperactivation),提升精子运动能力;
提高受精同步性,减少多精受精等异常受精风险;
为后续胚胎发育奠定基础,满足Ca²⁺依赖的细胞分裂等生理过程需求。
高钙配方是HTF的核心优势,同时也使其被标注“严禁冻存”的红色警示。冷冻过程会通过多重机制破坏培养液稳定性,最终影响受精效果。
冷冻程序中,培养液内的CO₂易逸出,导致碳酸氢盐(HCO₃⁻)向碳酸盐(CO₃²⁻)转化;而CO₃²⁻与Ca²⁺的结合能力更强,会形成稳定的碳酸钙沉淀。这些沉淀如同细沙悬浮于培养液中,既打破了原有的溶解平衡,又会导致培养液pH值偏离适宜范围,破坏缓冲体系。
HTF中含有较高浓度的牛血清白蛋白(BSA)等蛋白成分,在冻融过程中会发生变性结块,形成肉眼可见的絮状物,直接堵塞精子获能所需的微环境通道。
综上,沉淀析出、蛋白变性、pH波动的三重打击,会导致受精率出现断崖式下跌。
HTF的高钙设计是保障受精效率的核心前提,实际操作中需通过严格的平衡处理发挥其生理功能。使用HTF培养液前充分平衡CO₂浓度与温度,可有效避免碳酸钙沉淀形成、稳定培养液pH值,确保HTF模拟输卵管生理环境的核心作用正常发挥,进而实现>85%的受精率。
CZB、KSOM、M16三种经典胚胎培养液性能对比及应用选择

胚胎体外培养(In Vitro Culture, IVC)是胚胎工程领域的核心技术环节,培养液作为胚胎体外生长的核心微环境,其成分组成直接决定胚胎发育潜能及后续实验的可靠性。本文将从培养液的核心成分、性能特征及适用场景等方面对CZB、KSOM与M16三款经典胚胎培养液进行系统比对,为胚胎培养相关实验的培养液选择提供科学依据。
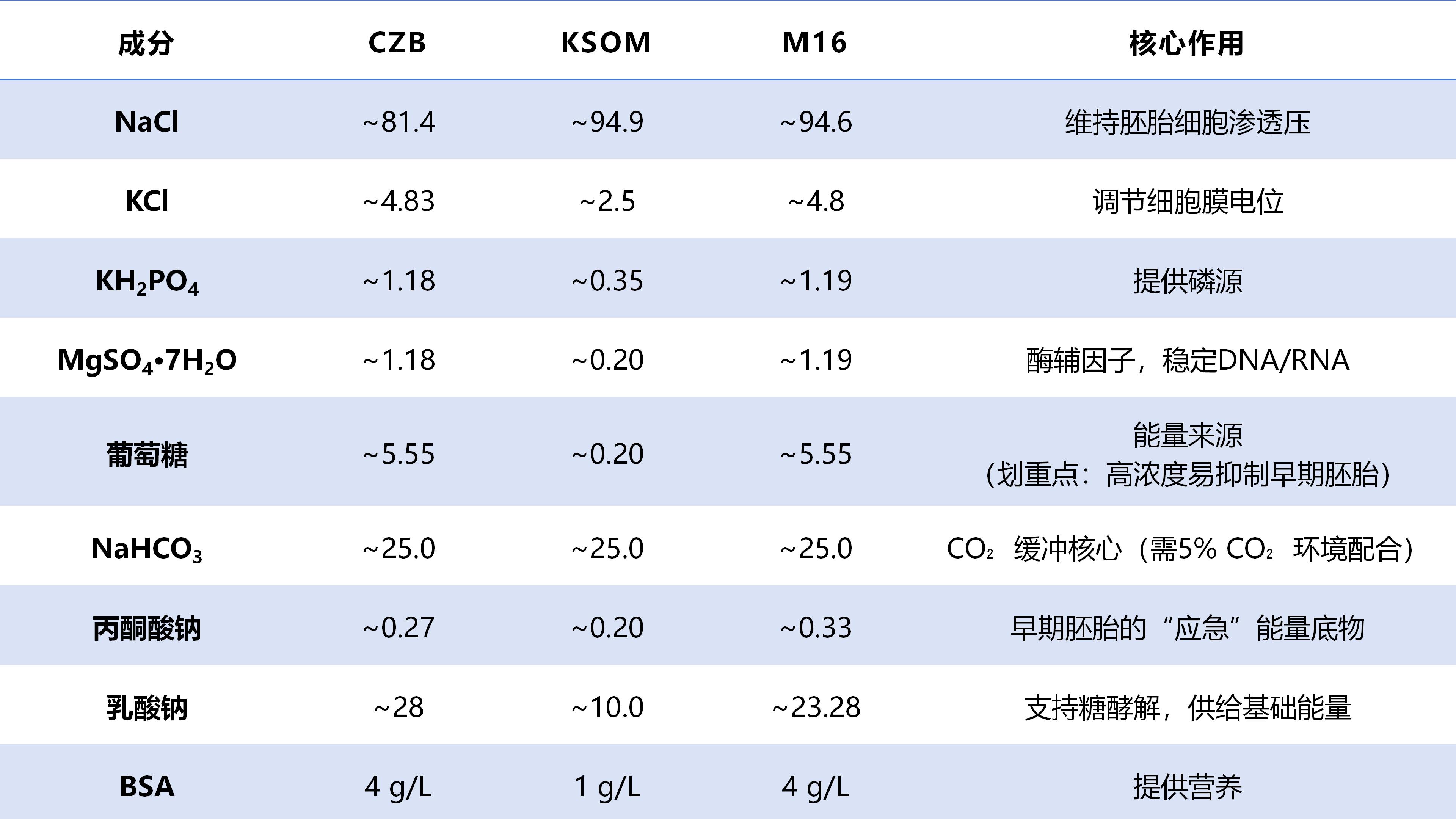
缓冲系统:三款培养液均含25 mM左右的NaHCO₃,该成分可与培养环境中的CO₂形成稳定缓冲对,确保培养液pH值维持在胚胎发育适宜的7.2-7.4范围,为胚胎提供CO₂缓冲系统。
能量底物:均同时提供丙酮酸和乳酸两种能量物质,支持胚胎从糖酵解到氧化磷酸化的代谢模式转换,满足不同发育阶段的能量需求。
基础离子:均包含Na⁺、K⁺、Ca²⁺、Mg²⁺等基础离子,通过离子平衡调节渗透压,保障细胞信号传导的正常进行。
KSOM —— 极低葡萄糖(0.20 mM)+氨基酸支持的黄金组合,适合小鼠合子至囊胚全程培养;低渗透压(~256 mOsm),更接近输卵管液环境。
CZB —— 高乳酸钠(28 mM),其能量底物组合偏向于支持糖酵解,支持从受精卵到桑葚胚的早期发育。
M16 —— 高葡萄糖(5.55 mM)+高丙酮酸(0.33 mM),氧化磷酸化支持型,更有利于能量需求巨大的囊胚形成和扩张,但需注意早期代谢压力。
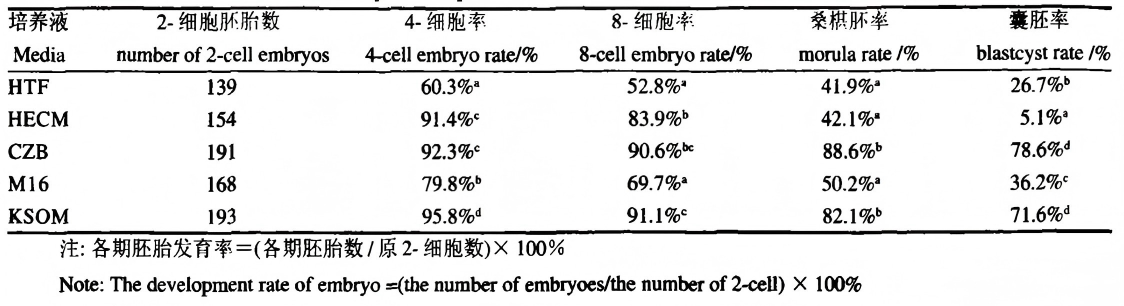
表2 不同培养液中C57BL/6J小鼠胚胎发育率的比较[1]
胚胎培养液未开封可保存4个月(按说明书条件保存);开封后需要在2周内使用。使用污染或成分变化的培养液可能导致胚胎分裂迟缓、碎片增多、囊胚形成率下降等胚胎发育异常,甚至引发实验室交叉污染,影响实验的正常进行。
pH失衡:胚胎培养液通常需维持特定pH(7.2-7.4)和渗透压。开封后,CO₂逸出可能导致pH升高(偏碱性),破坏胚胎生长的酸碱平衡;
氧化损伤:某些成分(如氨基酸)接触空气后可能氧化失效,或产生自由基,损害胚胎细胞;
营养断供:丙酮酸、乳酸等小分子物质可能因挥发导致浓度下降,生长因子如BSA可能因温度波动而变性;
渗透压紊乱:水分蒸发导致培养液渗透压升高,影响胚胎存活。
无菌环境被破坏:即使操作规范,多次开盖、吸液等操作仍可能引入环境中的微生物。
标记开封日期:严格记录开封时间,超期后废弃。
避免温度波动:开封后存放于稳定环境(如培养液专用冰箱)。
| 产品名称 | 货号 | 备注 |
|---|---|---|
| KSOM培养液 | M1435 | 添加氨基酸,高质量囊胚培养优选 |
| KSOM培养液(无EAA、NEAA) | M1436 | 常规培养,稳定突破早期发育阻滞 |
| CZB培养液 | M1655 | 专为克服小鼠胚胎体外培养中2-cell阻滞而设计 |
| CZB-Hepes培养液 | M2750 | HEPES缓冲体系,提供稳定的非CO₂依赖环境 |
| M16培养液 | M1735 | 高葡萄糖含量,支持后期囊胚腔快速形成 |
[1]贾青, 高娟, 杨博,等人. 小鼠体外受精及其胚胎体外培养的比较研究 [J] 实验动物与比较医学. Oct.2008.28(5).
KSOM 与 KSOM/AA:小鼠胚胎体外培养基的家族演进史

在哺乳动物胚胎体外培养的历程中,培养基的组成是决定发育成败的关键。从克服“二细胞阻滞”到支持高质量囊胚形成,KSOM(Potassium Simplex Optimized Medium) 家族的演进代表了该领域的重大突破。
在KSOM问世之前,小鼠胚胎体外培养常受困于“二细胞阻滞”,早期培养基(如M16)较高的钠离子和葡萄糖浓度可能对胚胎造成代谢压力。KSOM的诞生源于“单纯形优化(Simplex Optimization)”策略。J. David Biggers [1]让胚胎自身筛选最适配方,成功开发出SOM培养基。随后,基于对胚胎细胞内离子浓度的测量,团队在SOM中增加了钾离子(K⁺, 2.5 mM)和钠离子(Na⁺, 95 mM)的浓度,形成KSOM培养基。
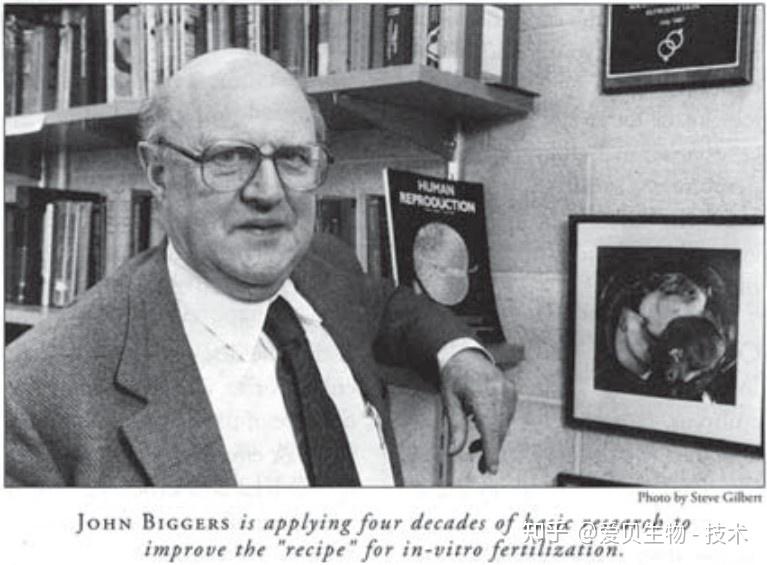
图1. 哈佛医学、牙科和公共卫生学院出版的《焦点》杂志上题为“受精卵的饮食“的采访,文章发表于1994年4月15日,描述了约翰在单纯形优化方面的工作[2]。
与传统培养基相比,KSOM的核心优势在于其“低钠高钾”的生理化离子组成。这种配方能更好地维持细胞内钠钾平衡,促进蛋白质合成与RNA稳定性,从而有效克服二细胞阻滞,显著提高从受精卵到囊胚的发育率。它标志着第一个真正为小鼠早期胚胎“量身定制”的化学成分明确培养基的诞生。
尽管KSOM已表现出色,但科学家发现,囊胚形成伴随的蛋白质合成爆发和囊胚腔流体转运,亟需氨基酸的支持。1995年,Ho, Yugong等人[3]的研究证实,在KSOM基础上添加必需与非必需氨基酸(形成KSOM/AA),带来了全方位的提升。
与KSOM(无AA)相比,KSOM/AA的优越性体现在多个维度:
在发育形态上,KSOM/AA不仅继承了基础款支持良好囊胚发育的能力,更显著提升了囊胚的形成速率与孵化比例,这表明氨基酸为胚胎在关键发育节点提供了额外动力,并增强了其着床潜力。
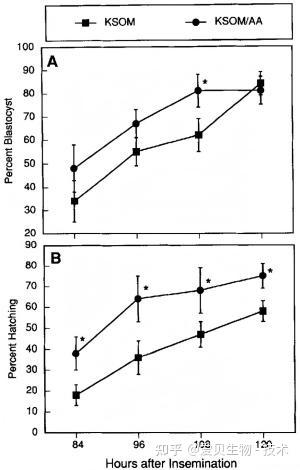
图2. KSOM或KSOM/AA中胚胎的发育率[3]。
在细胞水平上,最直观的进步体现在囊胚总细胞数的显著增加。这意味着在KSOM/AA中形成的胚胎具备更强的增殖能力和发育潜能。
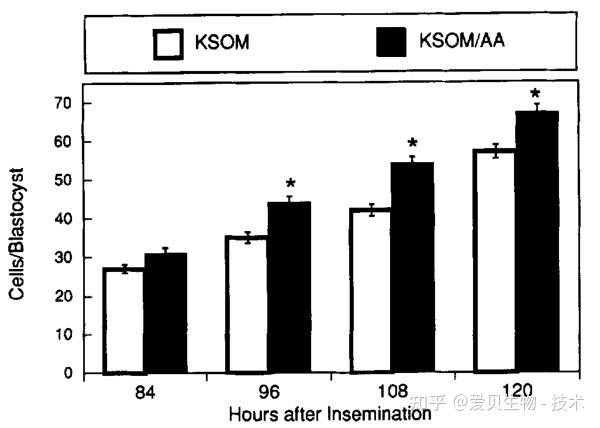
图3. 在KSOM或KSOM/AA中发育后每个囊胚的细胞总数[3]。
在分子层面,KSOM/AA带来了更深层次的优化。通过逆转录PCR分析发现,在其中发育的胚胎,其多个关键基因(如代谢、转录调控、生长因子等相关mRNA)的表达水平与体内发育的胚胎无显著差异。这表明,氨基酸的加入不仅提供了营养,更从根源上支持了胚胎建立更接近自然的基因调控网络。
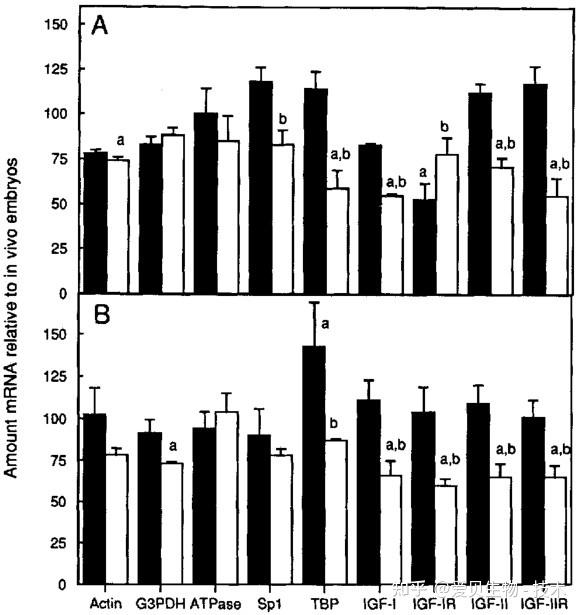
图4. 在KSOM/AA或Whitten培养基中发育的胚胎中特异性mRNA的相对丰度与体内发育的胚胎中的丰度的比较。黑色:KSOM/AA;白色:Whitten培养基[3]。
综上所述,KSOM/AA实现了从支持胚胎“存活”到保障胚胎“高质量”发育的质的飞跃,从而奠定了其作为小鼠胚胎培养“黄金标准” 的地位。
KSOM的成功并非终点。为了满足不同需求,其家族不断衍生优化:
· mKSOM(modified KSOM ):mKSOM-R [4]。
· 稳定性优化:采用甘氨酰-L-谷氨酰胺二肽替代不稳定的L-谷氨酰胺,减少氨毒性,进一步提高内细胞团(ICM)比例和胚胎质量[1]。
此外,基于KSOM/AA的研究挑战了传统培养理念。大量证据表明,使用KSOM/AA进行的单步培养,效果不逊于甚至优于需要更换液体的两步序贯培养,这为简化人类辅助生殖技术操作流程提供了科学依据。
KSOM家族的演进,体现了从“支持胚胎存活”到“保障胚胎高质量发育”的深刻转变。
· KSOM 的核心贡献在于通过生理化离子组成,为胚胎早期发育扫清了障碍(二细胞阻滞),奠定了坚实的基础。
· KSOM/AA 则在KSOM的基础上,通过精准的营养支持(氨基酸),实现了对胚胎发育速度、细胞数量、基因表达及后续潜能的全面优化。
因此,KSOM/AA不仅继承了KSOM的基石优势,更通过氨基酸的协同作用,实现了胚胎体外培养效果的终极目标——更接近体内发育状态。如今,它不仅是实验室研究小鼠胚胎的利器,其设计哲学与成功经验,也为人类辅助生殖技术的培养基优化提供了宝贵的参考。
关键词:KSOM、KSOM/AA、胚胎培养、氨基酸、囊胚、基因表达
相关产品
KSOM培养液 (M1435):适用于受精卵发育至囊胚阶段,无需中途换液。
KSOM培养液(无氨基酸版)(M1436):无AA 配方降低代谢废物堆积,克服小鼠2-cell阻滞。
从自然受精到体外受精,胚胎学家如何“骗”过生物体

在辅助生殖技术(ART)的发展历程中,科学家们始终面临一个难题:如何在体外准确重现生物体内的受精环境。自然受孕时,精子与卵子的相遇如同一场精心安排的 “约会”,发生在输卵管这个兼具舒适与安全的 “五星级酒店”;而实验室里的胚胎培养皿,在早期却只能算作条件简陋的 “招待所”。这两者之间的环境差距悬殊。
为了打破这一困境,科学家们开启了 “逆向工程” 的探索之路 —— 通过深入分析输卵管液与精液的成分,试图在小小的培养皿中,人工打造出与生物体生理环境高度相似的 “孕育温床”。而 HTF(Human Tubal Fluid,人输卵管液)和 TYH(Toyoda-Yokoyama-Hoshi)培养基,正是在这样的背景下应运而生,成为辅助生殖技术发展史上的关键里程碑。
一、HTF 培养液:破解早期胚胎的 “生存危机”
在试管婴儿(IVF)技术刚刚起步的阶段,胚胎在体外培养的过程中,始终面临着严峻的 “生存危机”—— 存活率非常低。科学家们经过反复研究发现,当时常用的普通培养液(如 DMEM、RPMI),无法满足早期胚胎的生长需求:胚胎细胞要么在培养过程中逐渐死亡,要么出现发育异常的情况,这成为制约试管婴儿技术发展的重要瓶颈。
事实上,输卵管液才是早期胚胎生长的 “黄金标准”,它蕴含着胚胎发育所需的各种营养物质。但问题是,不可能每次实验都从生物体中抽取输卵管液,这种方式既不现实,也存在伦理与操作上的诸多难题。
1985 年,Quinn 团队[1]取得了突破性进展。他们首次对人类输卵管液的成分进行了系统且全面的分析,揭开了这份 “生命营养液” 的神秘面纱:其中不仅含有特定浓度的离子(如 Na⁺、K⁺、Ca²⁺),还包含乳酸、丙酮酸等关键能量底物 —— 要知道,早期胚胎的能量供给主要依赖这些物质,而非人们通常以为的葡萄糖;此外,氨基酸和蛋白质也在其中扮演着重要角色。
基于这些发现,Quinn 团队成功研发出了 HTF 培养基。这款培养基完全复刻了输卵管液的核心成分,让胚胎在体外培养皿中,也能像在母体输卵管里一样,获得充足的营养与适宜的环境。直至今日,HTF 培养基依然是IVF的基础培养基之一,后续出现的各类商业化培养基(如Vitrolife G-1/G-2系列),几乎都是在 HTF 的基础上改良而来。
二、TYH 培养基:唤醒精子的 “获能密码”
二十世纪中叶,生殖领域的科学家们发现了一个有趣却关键的现象:刚射出的精子其实不具备受精能力,它们必须在雌性生殖道内经历一个特殊的 “修炼” 过程 ——获能(Capacitation),才能获得穿透卵子的 “本领”。
然而,在当时的实验条件下,早期使用的培养基(如 Krebs-Ringer 液)无法模拟 “获能” 过程的环境条件。这导致精子在体外培养时,就像离开水的鱼一般,毫无生机,更别提完成受精任务了。
1971 年,日本科学家 Toyoda 与 Yokoyama 在针对小鼠受精的研究中[2],迎来了关键性的突破。他们发现,牛血清白蛋白(BSA)能够模拟雌性生殖道的环境,有效诱导精子完成 “获能”;特定的离子组合(如 Ca²⁺、HCO₃⁻)对精子超激活运动(Hyperactivation)至关重要。基于这些发现,他们成功研发出了TY 培养基(Toyoda-Yokoyama Medium),首次在体外环境中实现了小鼠精子的 “获能” 与受精。
后来,研究者 Hoshi在 TY 培养基的基础上,进一步调整其成分,最终形成了如今广为人知的 TYH 培养基,成为小鼠IVF培养基界的 “黄金标准”。它不仅首次在体外成功复现了精子 “获能” 的关键环境,成为小鼠生殖研究领域不可或缺的 “标配” 培养基;也为人类IVF技术的发展奠定了基础。
科学:一场 “人工复刻” 自然的精妙艺术
从本质上来说,科学研究中的许多突破,都是一场 “人工复刻” 自然现象的精妙艺术。
HTF 培养基是科学家们用智慧创作的 “人工输卵管液”—— 它精准还原了输卵管的核心环境,为精卵结合创造了理想的平台;
TYH 培养基是科学家精心 “复现” 的雌鼠生殖道环境 —— 它成功唤醒了精子的 “活力密码”,让精子在体外环境下活力满满,顺利完成 “获能”。
HTF 与 TYH 这两种培养基的诞生,直接推动了现代辅助生殖技术的跨越式发展。它们让人类得以在实验室的可控条件下,精准调控精子与卵子的结合过程。
参考文献
[1] Quinn P, Kerin JF, Warnes GM. Improved pregnancy rate in human in vitro fertilization with the use of a medium based on the composition of human tubal fluid. Fertil Steril. 1985 Oct;44(4):493-8. doi: 10.1016/s0015-0282(16)48918-1. PMID: 3902512.
[2] Yutaka Toyoda1 and Minesuke Yokoyama. The early history of the TYH medium for in vitro fertilization of mouse ova. J. Mamm. Ova Res. Vol. 33 (1), 3–10, 2016
相关产品
HTF培养液 (M1135):无菌即用型小鼠IVF受精液,高钙配方,受精率>85%
TYH精子获能液 (M2035):含肝素,精子获能后受精率>85%
TYH精子获能液(环糊精版)(M2036):含环糊精(MBCD),适用于冷冻精子的获能培养液。
超数排卵:小鼠模型中的时间密码
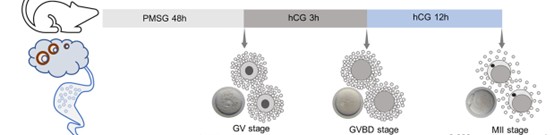
在辅助生殖与发育生物学研究中,超数排卵(superovulation)是获取高质量卵母细胞的关键技术。小鼠超数排卵推荐每只雌鼠注射PMSG 5-10 IU,48 h后注射HCG 5-10 IU,在注射HCG后14-16 h进行受精[1]。然而,PMSG与HCG的“48小时定律”背后,隐藏着卵泡同步化与卵母细胞成熟的精密时钟。
小鼠自然发情仅释放10–15枚卵子。通过外源激素干预,可突破这一限制:首先PMSG(孕马血清促性腺激素)模拟FSH效应,同步募集并激活大量原始卵泡,使其发育至有腔阶段,此时的卵母细胞仍停滞于第一次减数分裂双线期(GV期);间隔48 h后给予HCG(人绒毛膜促性腺激素),模拟LH峰,诱导GV期卵母细胞恢复减数分裂,排出第一极体并停滞于第二次减数分裂中期(MII)。最终,在输卵管壶腹部聚集大量同质化的MII期卵子,为体外受精和后续胚胎操作提供充足且高质量的材料。
PMSG通过模拟FSH,需44-48小时募集足够数量的小卵泡并使其同步发育至排卵前阶段。George[2]研究发现,将PMSG-HCG间隔从48小时延长至60小时,并未提升小鼠见栓率与受精率(Table 1.);与此同时,延长注射时间也未能协助胚胎克服2-细胞阻滞(Table 2.)。这一结果提示,48小时可能是卵泡群同步化与卵母细胞核成熟的“黄金窗口”。
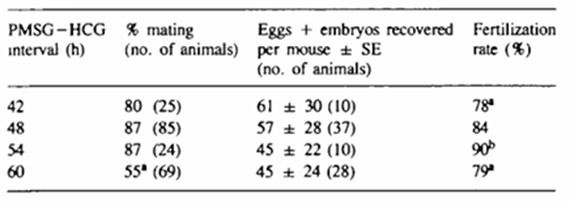

注射HCG模拟LH峰后,卵母细胞恢复减数分裂,经历生发泡破裂(GVBD),最终在12-14小时内完成第一次减数分裂并排出第一极体,达到MII,此时方具备受精能力(Figure 1.)。取卵时机必须精准契合此成熟窗口:过早取卵(如HCG后<12小时)可能获得大量停滞在GV期或MI期的未成熟卵母细胞,无法受精;而过晚取卵(如HCG后>16小时),卵母细胞则开始进入老化阶段,表现为皮质颗粒提前释放、纺锤体结构异常等,从而导致受精率下降或胚胎发育潜能受损。因此,HCG后14-16小时是获取成熟MII期卵母细胞并进行受精的理想时间窗。
• 激素保存:PMSG与HCG均为糖蛋白,反复冻融会导致空间结构变性。建议单次分装-20℃保存,避免活性损失。
• 取卵时机:HCG注射后14-16小时后取卵,可最大化获取输卵管壶腹部成熟卵母细胞。
George等的数据警示我们:在超数排卵方案中,时间间隔并非“越长越好”。延长激素间隔可能扰乱卵泡微环境,最终损害胚胎基因组激活。未来需结合单卵母细胞转录组与实时成像技术,解析48小时定律的分子计时器。48小时,是进化赋予小鼠的生殖节拍器;14-16小时,是卵母细胞等待精子的终极倒计时。精准把握每一小时,才能让每一次超排成为“质量”而非“数量”的胜利。
小鼠麻醉剂选择指南

在动物实验研究中,不少科研人员曾遭遇 “麻醉过浅导致小鼠挣扎”、“麻醉过深引发死亡”、“恢复期过长影响观察” 等问题。小鼠麻醉剂的合理选择,直接关系到实验安全性、数据准确性与动物福利。 针对动物实验中最常用的四种麻醉剂 —— 三溴乙醇、异氟烷、水合氯醛、戊巴比妥钠,本文从给药方式、时间特性、优缺点及适用场景等维度进行特性对比,为您的实验顺利开展提供科学方案。 三溴乙醇核心优势 麻醉深度可控,降低操作风险 异氟烷虽起效快,但需专业气体麻醉设备,操作不当可能导致人员暴露; 水合氯醛麻醉效果不稳定,易出现 “麻不倒” 或 “醒不来” 的情况; 戊巴比妥钠呼吸抑制作用强,更适用于终末实验; 三溴乙醇专为啮齿动物设计,通过腹腔注射即可实现稳定麻醉,无需担心深度失控。 对小鼠生理影响小 部分麻醉剂(如戊巴比妥钠)会强烈抑制小鼠呼吸与心跳,导致生理指标偏差。三溴乙醇对心血管系统影响轻微,能维持小鼠稳定的生理状态,尤其适合需监测精准生理数据的实验。 恢复期时间长度适中 若小鼠苏醒后仍处于意识模糊状态,会干扰后续生理指标监测与实验结果判断。三溴乙醇恢复期仅1 - 2小时,小鼠可快速恢复正常状态,不影响后续实验观察。 高性价比 即用型三溴乙醇溶液无需额外投入麻醉设备,开盖即可使用,大幅节省实验经费。 三溴乙醇使用要点特性 三溴乙醇 异氟烷 水合氯醛 戊巴比妥钠 给药方式 腹腔注射 吸入 腹腔注射 腹腔/静脉注射 起效时间 1-3分钟 30-60秒 5-15分钟 3-5分钟 麻醉时长 15-45分钟 可调 30-60分钟 45-90分钟 恢复时间 1-2小时 5-10分钟 2-4小时 4-8小时 优点 麻醉平稳,对心肺影响小,恢复快 可控性强,代谢快 便宜、对心血管影响小 麻醉深且稳定 缺点 1. 易分解,需避光保存
2. 不同品系小鼠对剂量的反应差异较大1. 需要气体麻醉设备
2. 操作者暴露风险1. 麻醉不稳定
2. 腹膜刺激大呼吸抑制强,易致死 适用场景 短-中时长手术 需精确控制的手术 预算有限的短时麻醉 终末实验(不打算让鼠醒)
1. 严格把控新鲜度,现配现用
三溴乙醇易分解失效,建议现配现用。以爱贝生物即用型三溴乙醇溶液(货号:M2910)为例,未拆封试剂可保存 6 个月,开封后 建议室温避光保存或4-8℃冷藏避光保存,且使用周期不超过2周。特别提醒:冷藏保存温度不得低于4℃,且使用前需对光检查是否产生结晶,以免影响试剂效果。本试剂严禁冷冻。
2. 精准控制剂量,提前设计预实验
常规推荐剂量为 125-250 mg/kg(腹腔注射),但不同品系小鼠对药物敏感度存在差异,正式实验前需进行预实验,确定合适的剂量。
3. 麻醉后做好保温,避免体温过低
小鼠麻醉后体温易下降,可能引发心率失常、血压骤降甚至死亡。需使用加热垫、红外灯或专用保温设备维持体温。爱贝生物专为小鼠实验设计的小动物金属保温热台(货号:ABHOT04),配备数字化温度设定模块与专用温度传感器,可提供稳定温度控制;同时搭配专用围栏,能防止小鼠苏醒后爬出跌落。
4. 实时监测麻醉深度,避免中途苏醒
麻醉深度过浅:无法维持稳定麻醉状态,小鼠中途苏醒挣扎,可能直接导致实验失败;
麻醉深度过深:显著提升副作用发生率与死亡率,严重影响实验数据有效性。
两种判断麻醉深度的方法:
① 捏脚趾法:轻掐小鼠后脚趾,无反应则说明麻醉深度合适;
② 角膜反射法:用棉签轻触小鼠眼角,无眨眼动作即表示麻醉状态达标。
选用合适的小鼠麻醉剂,是保障实验成功的关键一步。若您需要更详尽的实验技术信息,欢迎随时联系我们,获取专业支持!
胚胎培养"生命鸡尾酒" —— HTF与TYH配方详解

胚胎培养技术,是体外受精实验成功的核心环节。HTF培养液与TYH精子获能液,如同为胚胎发育量身定制的 “生命鸡尾酒”—— 前者护航胚胎培育,后者助力精子激活,各有不可替代的作用。本文将详细介绍这两款培养液的科学配方与应用要点。
首先,将HTF与TYH的关键成分进行对比,直观感受”生命鸡尾酒“调配的艺术:
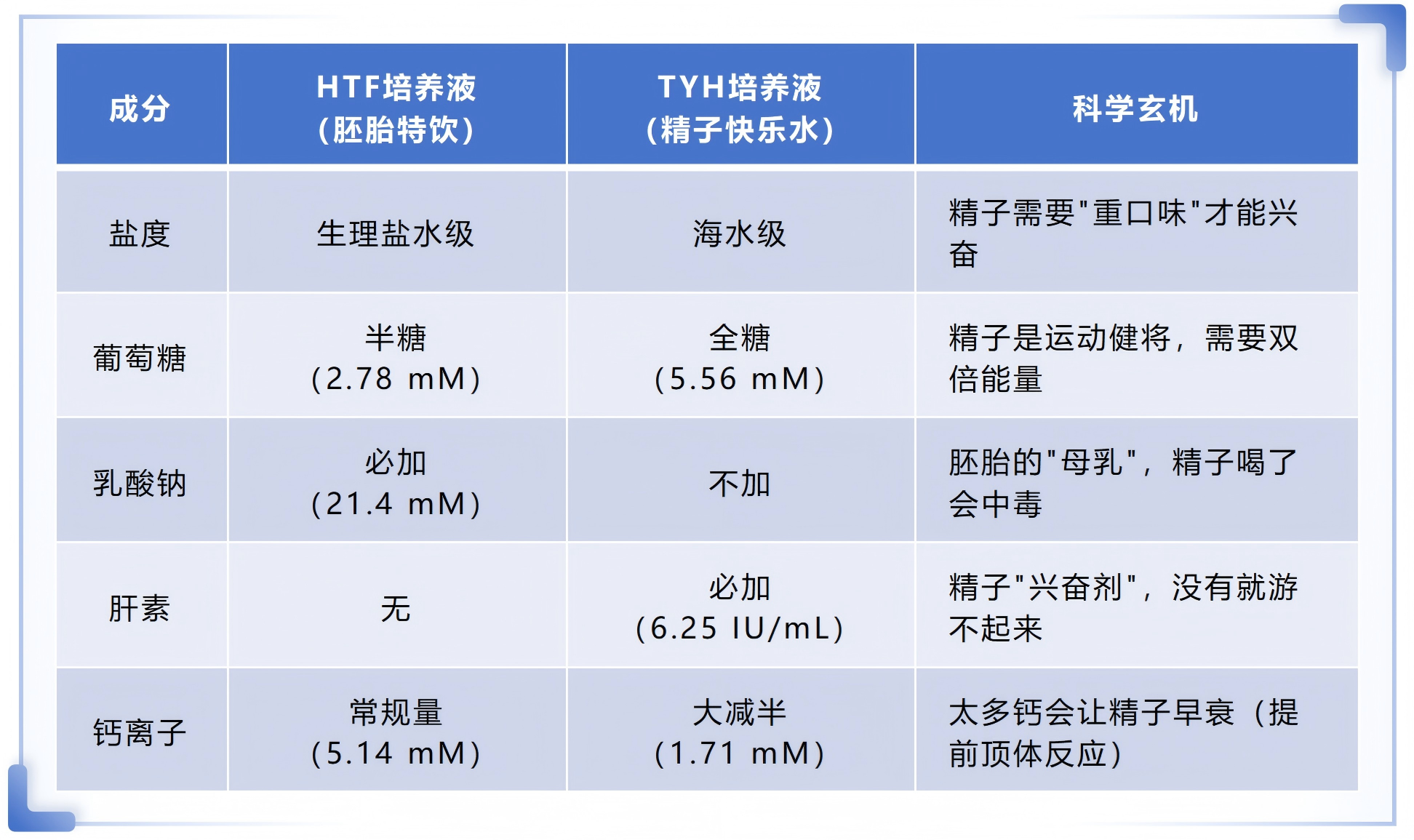
HTF培养液(货号:M1135)如同为胚胎打造的 “专属月子餐”,注重营养均衡与环境稳定。
TYH精子获能液(货号:M2035)则是为精子定制的 “能量补给站”,聚焦活力激活与能量供应。
错用培养液的风险
错用HTF培养精子会出现精子活力显著下降、甚至 “停滞不动” 的情况。核心原因在于:一方面,HTF缺乏肝素这一 “精子兴奋剂”,无法促进精子获能;另一方面,其葡萄糖浓度仅为TYH的一半,难以满足精子高能量消耗需求,如同让运动员 “空腹参赛”,无法发挥正常活性。
错用TYH培育胚胎会导致胚胎发育停滞、甚至凋亡。主要原因是:TYH不含胚胎所需的 “能量物质” 乳酸钠,相当于切断胚胎的 “营养供给”;同时,其高盐环境如同让婴儿饮用海水,远超胚胎耐受范围,破坏胚胎发育微环境。
总结
HTF培养液的优势
适宜的钙离子浓度:如同卵子激活的 “钥匙”,为胚胎受精及后续分裂提供适宜的离子环境,保障胚胎正常发育节奏。
乳酸钠:堪称胚胎的 “液态黄金”,是早期胚胎的能量来源,直接决定胚胎存活与发育效率。
TYH培养液的亮点
高糖高盐配方:相当于精子的 “加速能量泵”,高葡萄糖满足精子运动的高能量需求,高盐环境则维持精子活性稳定。
肝素:作为精子的 “活力补给站”,可快速激活精子活力,促进精子获能,是精子具备受精能力的关键因素。
两款培养液的共性特点
HTF与TYH培养液均添加牛血清白蛋白(BSA),如同为细胞提供 “蛋白质奶盖”,起到保护细胞、维持渗透压稳定的作用。
科普环节
TYH为何添加酚红
酚红并非为了提升外观颜值,而是作为重要的 pH 指示剂。精子在代谢过程中会持续产生酸性物质,当培养基 pH 值下降到一定程度时,酚红会使培养基颜色由红变黄,此时需及时更换培养液,避免酸性环境影响精子活力。
乳酸钠在HTF中的重要性
早期胚胎无法直接利用葡萄糖,如同“无法消化主食的婴儿”。乳酸钠如同“初乳”,是早期胚胎仅有的能量来源。直到胚胎发育至 8-cell期后,才算完成 “断奶”,具备利用葡萄糖的能力。
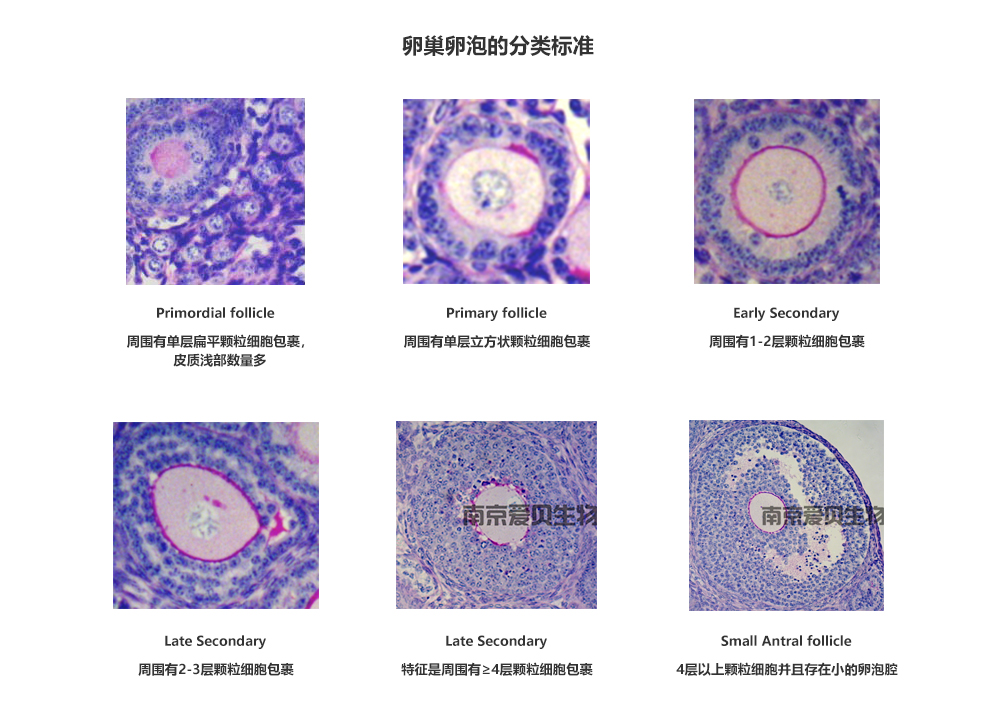
小鼠卵巢各级卵泡计数

石蜡切片的制作步骤
HE染色
卵泡计数
●在倒置显微镜下对整个卵巢连续切片中的各级卵泡进行计数。各级卵泡分类见下图,为了避免重复计数同一卵泡,只计数可见卵母细胞核的卵泡。